REFLEXIONES NUTRICIONALES DE LOS AMINOÁCIDOS

Autor: Profesor Diego A. Bonilla Ocampo
MTX COLLEGE DIRECTOR
Comencemos resaltando que los diversos estudios realizados han indicado que el crecimiento del músculo esquelético depende de manera crítica de los nueve aminoácidos esenciales (histidina, isoleucina, leucina, lisina, metionina, fenilalanina, treonina, triptófano y valina) (McLain TA, et al. 2015), aminoácidos que no pueden ser producidos endógenamente (es decir, por la reacciones metabólicas al interior del cuerpo humano) y, por lo tanto, deben ser administrados en cantidades y proporciones adecuadas por la dieta. La necesidad de los aminoácidos esenciales por parte del músculo esquelético es una consideración importante que conduce a clasificaciones de calidad proteica, fuentes óptimas de proteína y dosis óptimas requeridas de proteína (American College of Sports Medicine, Academy of Nutrition and Dietetics, & Dietitians of Canada, 2016). Por otro lado, los aminoácidos no esenciales (alanina, ácido aspártico, ácido glutámico y serina) pueden ser producidos al interior del cuerpo, mientras que otros aminoácidos pueden ser clasificados como condicionalmente esenciales (arginina, asparagina, cisteína, glutamina, prolina y tirosina), específicamente durante periodos en donde el cuerpo no puede sintetizarlos en cantidades adecuadas (enfermedad o altos volúmenes de actividad física) (McLain TA, et al. 2015; Fukagawa NK, 2014).
Los roles metabólicos de los aminoácidos son diversos e incluyen al menos cuatro funciones principales que se muestran en la siguiente imagen (Figura 1):
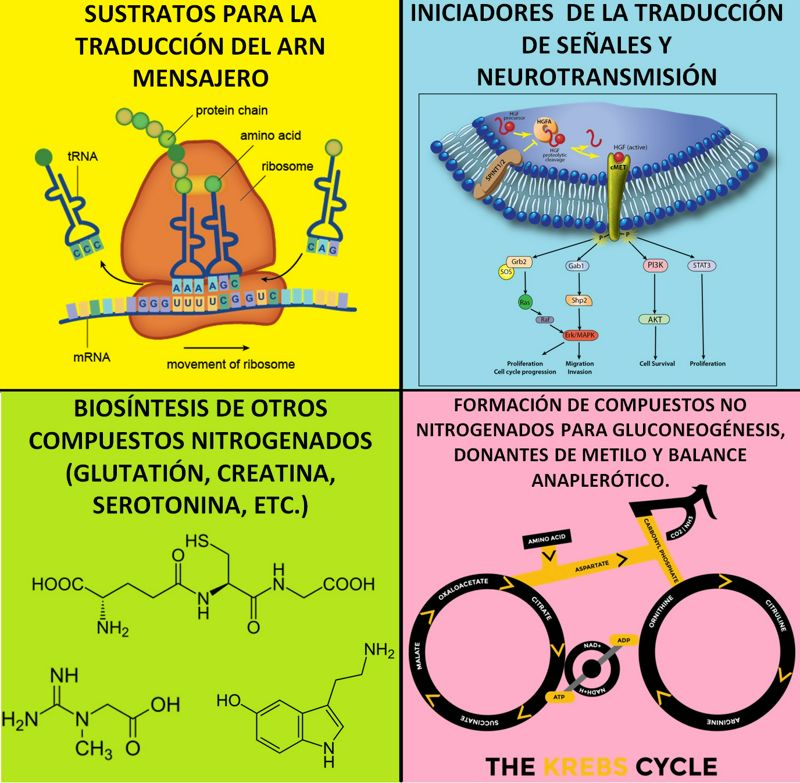
Figura 1. Los cuatro roles principales de los aminoácidos. Podemos resumir las funciones más importantes de los aminoácidos en cuatro; primera, sustratos para la síntesis de proteínas en el proceso de traducción del ARN mensajero; segundo, iniciadores de la traducción de señales y vías de neurotransmisión; tercera, producción endógena de otros compuestos nitrogenados (ej., glutatión, creatina, serotonina, taurina, etc.); cuarta, la formación de esqueletos carbonados sin nitrógeno que puedan servir en la gluconeogénesis, los donantes de grupos metilo y el correcto balance de reacciones anapleróticas (vías metabólicas que suministran intermediarios del ciclo de Krebs).
Para cada uno de estos roles, las concentraciones plasmáticas e intracelulares de aminoácidos, además de la ingesta dietaria, afectan el flujo de estas moléculas a través de diversas vías y, por lo tanto, posteriormente se evidencia un resultado fisiológico específico (ej., ver Figura 2). Algunas de estas rutas metabólicas, y sus efectos celulares, son sensibles a la ingesta de proteína dietaria y se relacionan muy bien con ciertos índices de salud que deben ser tenidos en cuenta para determinar los objetivos dietarios de la ingesta proteica.
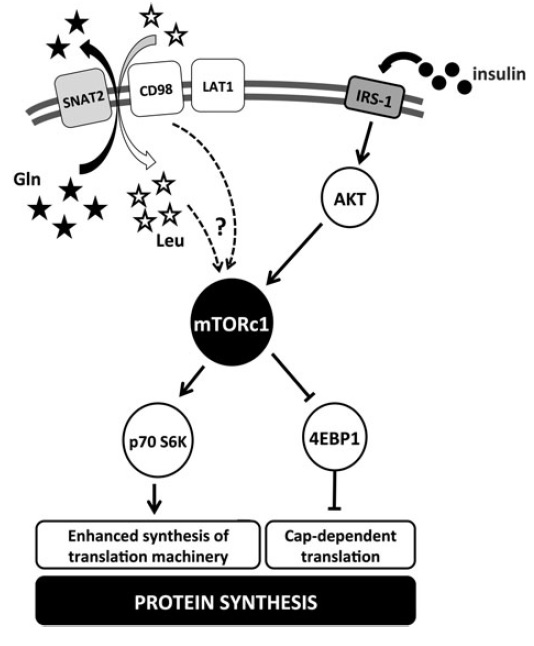
Figura 2. Diagrama simplificado de la señalización del complejo mTORC1. El esquema representa la regulación del mTORC1 sobre la síntesis de proteína en respuesta a señales extracelulares. SNAT, transportador de aminoácidos neutros acoplado a sodio; LAT1, transportador de aminoácidos tipo L; IRS.1, sustrato 1 del receptor de insulina; Gln, glutamina; Leu, leucina; 4EBP1, proteína ligada al factor eucariótico de iniciación 4E. Tomado de Murton AJ, 2015.
A continuación, se describen algunos detalles a tener en cuenta en relación a los aspectos nutricionales de los aminoácidos:
1. RESPECTO AL APORTE DE AMINOÁCIDOS NO ESENCIALES Y ESENCIALES.
Se ha hecho especial hincapié en la necesidad del aporte dietético de los aminoácidos esenciales. Esto no significa en modo alguno que se pueda prescindir de los aminoácidos en la alimentación por el hecho de que se puedan sintetizar en el organismo. Además de la “esencialidad” de los aminoácidos está la “esencialidad” del grupo amino. Este grupo no se puede sintetizar en el organismo. Por tanto, si no se aportan en la dieta suficiente aminoácidos incluyendo los no esenciales, la falta de grupos amino impedirá la síntesis de aminoácidos no esenciales, aunque se disponga de los esqueletos carbonados correspondientes (Marinin JC, 2015).
Así, la dieta debe proporcionar aminoácidos esenciales y no esenciales en cantidad suficiente (mínimo proteico), aunque en ocasiones la suplementación se hace necesaria, particularmente en deportistas con altas demandas energéticas y aquellos sometidos a un estrés considerable por ejercicios de larga duración. Además, el problema se plantea en determinadas fórmulas infantiles o para nutrición enteral, para las que hay que partir de proteínas que sean capaces de suministrar una cantidad equilibrada y suficiente de ambos tipos de aminoácidos (Álvarez L & Iglesias I, 2004).
2. RESPECTO A LA ABSORCIÓN INTESTINAL DE DIPÉPTIDOS Y TRIPÉPTIDOS.
La proteína dietaria provee de los aminoácidos esenciales para la síntesis de nuevas proteínas, además de otras funciones metabólicas descritas en la Figura 1. Sin embargo, se debe hacer énfasis en el hecho que muchas de estas funciones son sensibles a las concentraciones postprandiales de aminoácidos en plasma y al interior de la célula.
Investigaciones recientes se han enfocado en los aminoácidos como señalizantes metabólicos que influencian la tasa de síntesis de proteína, la velocidad de respuesta y resolución de la inflamación, la actividad mitocondrial y la saciedad (Layman DK, et al. 2015); actualmente, se considera que los aminoácidos ejercen esta regulación metabólica a través de sistemas señalizantes que incluyen mTORC1, la proteína cinasa regulada por limitación de nutrientes (GCN2, General Control Nonderepressible), el péptido similar al glucagón 1 (GLP-1, Glucagon-like Peptide 1), el péptido YY (PYY), serotonina y la insulina. Obviamente, estas señales representan una serie de respuestas fisiológicas a la ingesta de proteína. De hecho, la señal mejor caracterizada es la activación de mTORC1 inducida por leucina, la cual permite la estimulación de la síntesis de proteína muscular luego de una comida que contiene proteína. La respuesta de esta ruta metabólica a la proteína dietaria (ej., umbral de aprovechamiento alimentario – meal threshold, Figura 3) disminuye con el avance de la edad o la actividad física reducida (Layman DK, et al. 2015).
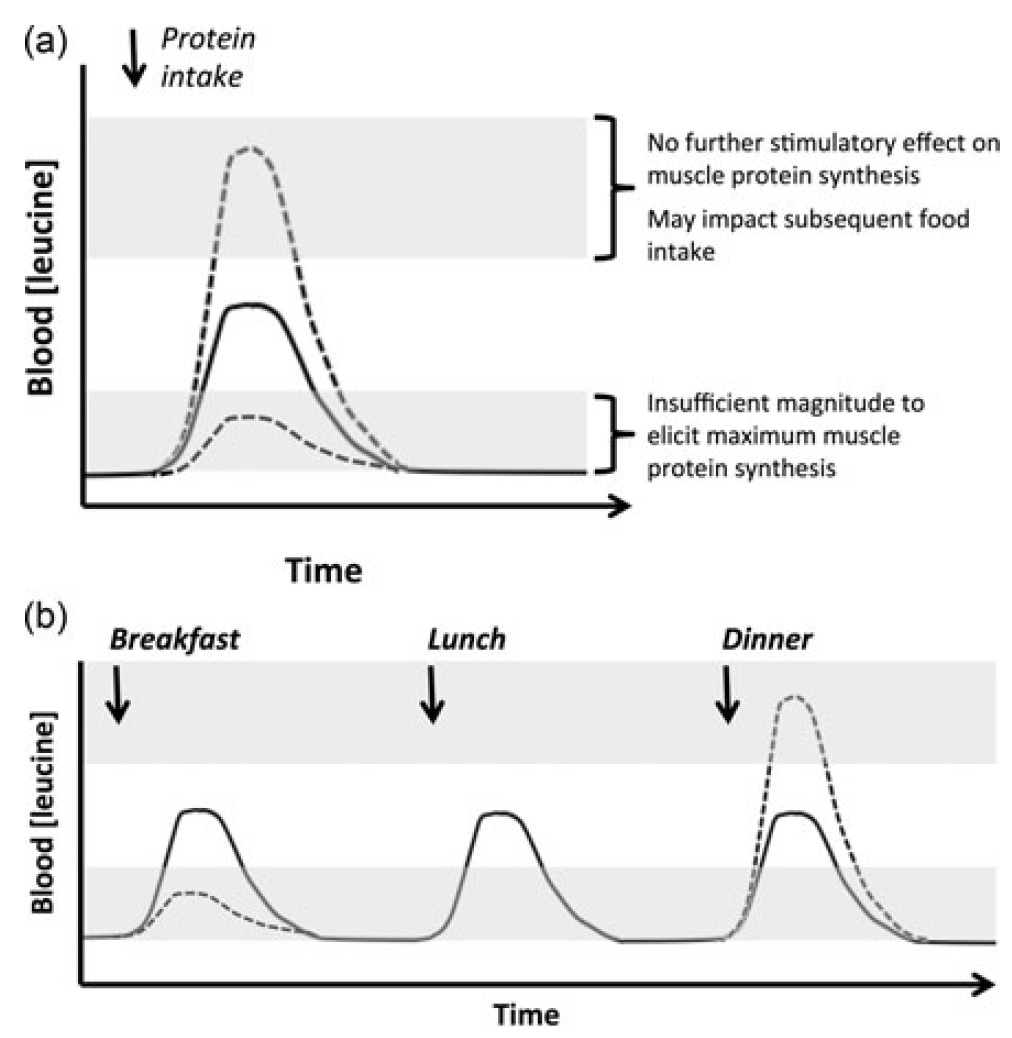
Figura 3. Aplicación del concepto de Umbral de Aprovechamiento Alimentario – Meal Threshold. (a) Un ejemplo ilustrativo del beneficio de mantener una hiperleucinemia postprandial dentro del umbral de aprovechamiento. (b) Consecuencias anticipadas de las concentraciones de leucina en un patrón heterogéneo de ingesta de proteína (- – -) con respecto a una estrategia de ingestas balanceadas de proteína a lo largo de las comidas del día (___). Tomado de Murton AJ, 2015.
El hecho de que los dipéptidos y los tripéptidos se puedan absorber sin necesidad de hidrólisis previa en el lumen intestinal tiene un gran interés en la preparación de fórmulas en las que no se pueden introducir proteínas. Los péptidos pequeños tienen la ventaja sobre los aminoácidos de que originan una osmolaridad menor y tienen, además, un menor costo de producción. La disminución de la osmolaridad es muy importante para prevenir las correspondientes diarreas osmóticas (Álvarez L & Iglesias I, 2004).
3. RESPECTO AL TRANSPORTE DE AMINOÁCIDOS A TRAVÉS DE LA MEMBRANA CELULAR.
La competitividad entre aminoácidos de un mismo grupo respecto a su mecanismo de transporte hace que estos deban mantener un cierto equilibrio o proporción entre ellos ante cualquier célula, bien sea mucosal o la barrera hematoencefálica para que no se afecte el paso de otros.
El ejemplo más claro ocurre en la situación de insuficiencia hepática en la que es clave la competencia entre aminoácidos aromáticos y ramificados en su paso por la barrera hematoencefálica, ya que ambos tipos de aminoácidos comparten el mismo mecanismo de transporte.
4. AMINOÁCIDOS EN EXCESO Y FORMACIÓN DE GRASA.
No existen depósitos proteicos de reserva en el organismo. Por tanto, el excesivo consumo de proteínas origina su utilización energética y, de esta manera, la producción de esqueletos carbonados que puede producir grasa. En algunos casos, cuando el catabolismo de los aminoácidos produce Acetil CoA, la grasa se puede producir en el propio hígado y ser exportada a los tejidos periféricos. En otros casos, cuando los aminoácidos originan en su catabolismo intermediarios gluconeogénicos, será la glucosa la que se convertirá en grasa en el tejido adiposo. Hay que tener en cuenta, además, que la utilización energética de las proteínas, cuando se consumen en exceso y la dieta es hipercalórica, significa un ahorro en el consumo catabólico de azúcares y grasas y, así, un estímulo para su acumulación final como grasa adiposa (aspecto característico de las dietas de volumen en algunos deportes de fuerza).
Por Diego A. Bonilla Ocampo
MTX NUTRITION Science Product Manager
MTX COLLEGE Director
REFERENCIAS
1. Tipton KD & Wolf R. Exercise, Protein Metabolism and Muscle Growth. Int J Sport Nutrition and Exc Metab. 2001, 11 (1): 109-132.
2. Di Pasquale, M. Amino Acids and Protein for the Athletes, The Anabolic Edge. CRC Press Boca Raton New York, 1997.
3. Phillips SM, Van Loon LJ. Dietary protein for athletes: from requirements to optimum adaptation. Journal of Sports Sciences. 2011; 29 (Suppl 1): S29–38.
4. American College of Sports Medicine; American Dietetic Association; Dietitians of Canada. Joint Position Statement: Nutrition and Athletic Performance. Medicine & Science in Sports & Exercise. 2016, 116 (3): 501-528.
5. Álvarez L & Iglesias I. Asignatura; Avances en Alimentación y Nutrición. Biblioteca Fundación Universitaria Iberoamericana, 2004.
6. Layman DK, Anthony TG, Rasmussen BB, Adams SH, Lynch CJ, Brinkworth GD & Davis TA. Defining meal requirements for protein to optimize metabolic roles of amino acids. Am J Clin Nutr 2015; 101 (Suppl): 1330S–1338S.
7. Pasiakos SM, Marolis LM & Orr JS. Optimized dietary strategies to protect skeletal muscle mass during periods of unavoidable energy deficit. FASEB Journal. 2015, 29: 1136–1142.
8. McLain TA, Escobar KA & Kerksick CM. Protein Applications in Sports Nutrition—Part I: Requirements, Quality, Source, and Optimal Dose. Strength and Conditioning Journal, 2015. 37 (2): 61-71.
9. Lemon PW. Protein and amino acid needs of the strength athlete. Int J Sport Nutr, 1991, 1: 127-145.
10. Fukagawa NK. Protein requirements: methodologic controversy amid a call for change. Am J Clin Nutr, 2014, 99 (4): 761-762.
11. Marinin JC. Protein Requirements: Are We Ready for New Recommendations? J Nutr, 2015, 145(1): 5-6.
12. Murton AJ. Muscle protein turnover in the elderly and its potential contribution to the development of sarcopenia. Proceedings of the Nutrition Society, 2015, 74: 387–396.